Equilibrio Líquido-Vapor de soluciones de acetona(1) y cloroformo(2)
8. Se dispone de los siguientes datos para las soluciones de acetona y cloroformo a 50ºC: Calcular los coeficientes de actividad de ambos componentes y trazar su gráfica conforme a las expresiones de Van Laar para determinar las constantes empíricas del sistema (A y B). ¿Tienen alguna interpretación los coeficientes de Van Laar en función de las interacciones entre componentes de las soluciones?
Contents
- Preparacion
- Introducción de datos
- Determinación de la presión de vapor de compuestos puros
- Determinación de los coeficientes de actividad
- Representación gráfica de resultados
- Determinación de la Energía Libre de Gibbs de Exceso
- Representación gráfica de resultados
- Aplicación del modelo de van Laar
- Representacion grafica de los resultados
- Conclusión
Preparacion
clear all % Borramos toda posible variable clc % Limpiamos la pantalla de comando close all % Cerramos toda ventana de figura
Introducción de datos
Primera columna: fracción molar en acetona x_1 en fase líquida Segunda columna: fracción molar en acetona y_1 en fase vapor Tercera columna: presión de equilibrio en mmHg
xyP=[0.00 0.00 521;
0.1 0.071 495;
0.2 0.165 474;
0.3 0.279 463;
0.38 0.38 458;
0.4 0.408 460;
0.5 0.55 469;
0.6 0.684 489;
0.7 0.789 511;
0.8 0.89 540;
0.9 0.955 576;
1 1 612];
% Creamos un arreglo de columnas para la composición del líquido
% La primera columna contiene la fracción molar en acetona, la segunda en
% cloroformo. No tomamos ni la primera ni la última fila porque contienen la
% presión de vapor de los compuestos puros
x=[xyP(2:end-1,1) 1-xyP(2:end-1,1)];
y=[xyP(2:end-1,2) 1-xyP(2:end-1,2)];
P=xyP(2:end-1,3);
Determinación de la presión de vapor de compuestos puros
P1vap=xyP(end,3); % Pvap de acetona en mmHg P2vap=xyP(1,3); % Pvap de cloroformo en mmHg
Determinación de los coeficientes de actividad
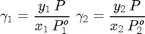
Para todos los cálculos usamos los operadores precedidos de punto ya que necesitamos operaciones elemento a elemento
gamma1=y(:,1).*P./(P1vap.*x(:,1)); gamma2=y(:,2).*P./(P2vap.*x(:,2));
Representación gráfica de resultados
figure plot(x(:,1), gamma1, '+-b', x(:,1), gamma2, '*-r') xlabel('Fracción molar en fase líquida x_1') ylabel('\gamma_1 & \gamma_2') title('ELV acetona(1)/cloroformo(2) a T=50^oC') grid on % El sistema presenta desviaciones negativas de la idealidad % Para cada compuesto la fugacidad en solución es inferior a la que tendría % en una solución ideal de la misma composición a la misma T y P

Determinación de la Energía Libre de Gibbs de Exceso
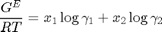
GERT=x(:,1).*log(gamma1)+x(:,2).*log(gamma2); GERTx1x2=GERT./x(:,1)./x(:,2); x1x2GERT=1./GERTx1x2; % Las desviaciones de la idealidad son negativas y sugieren que no hay una % influencia significativa de la forma y tamaño en las moléculas, puesto que % la parábola G^E/RT es casi simétrica alrededor de su foco. % Las desviaciones de la idealidad están causadas por una fuerte diferencia % de polaridad entre las moléculas
Representación gráfica de resultados
figure plot(x(:,1), GERT, '+-b') xlabel('Fracción molar en fase líquida x_1') ylabel('GE/RT') title('ELV acetona(1)/cloroformo(2) a T=50^oC') grid on

Aplicación del modelo de van Laar
El modelo de van Laar establece que: $$ \frac{x_1x_2}{\frac{G^E}{RT}}=\left(\frac{1}{A_{21}}-\frac{1}{A_{12}}\right)x_1+\frac{1}{A_{12}} $
Y=x1x2GERT; % Variable dependiente a modelar X=x(:,1); % Variable independiente a modelar gradoPolinomio=1; % Se requiere una línea recta Y=Pendiente*X+Corte b=polyfit(X,Y,gradoPolinomio) % b contiene coeficientes del polinomio (pendiente y corte) Ycalc=polyval(b,X) % Estimamos las predicciones del modelo Residuos=Y-Ycalc; % Estimamos los errores de las predicciones % Análisis de la bondad del ajuste whichstats={'rsquare', 'adjrsquare', 'fstat'}; stats=regstats(Y,X,'linear', whichstats); r2=stats.rsquare % Factor de correlación o r cuadrado debe estar cercano a 1 adjr2=stats.adjrsquare % Factor de correlación ajustado debe estar cercano a 1 y a r2 valorp=stats.fstat.pval % Valor p para el análisis de varianza de la regresión p<\alpha, \alpha=0.05
b = -0.099585233228802 -1.229992936114284 Ycalc = -1.239951459437164 -1.249909982760044 -1.259868506082924 -1.267835324741229 -1.269827029405805 -1.279785552728685 -1.289744076051565 -1.299702599374445 -1.309661122697325 -1.319619646020205 r2 = 0.250518308796628 adjr2 = 0.156833097396207 valorp = 0.140635702095649
Representacion grafica de los resultados
figure plot(x(:,1), x1x2GERT, '+b', x(:,1), Ycalc,'*-r') xlabel('Fracción molar en fase líquida x_1') ylabel('x_1x_2/(GE/RT))') title('ELV acetona(1)/cloroformo(2) a T=50^oC') grid on legend('Exp','Ajuste van Laar')

Conclusión
El modelo de van Laar no representa adecuadamente el ELV del sistema acetona-cloroformo a 50 ^oC tal como se esperaba, puesto que éste presenta desviaciones negativas de la Ley de Raoult, y el modelo de van Laar sólo es capaz de describir desviaciones positivas Sin embargo notamos que las constantes de van Laar son ambas negativas guardando una relación con el tipo de desviaciones mostradas por el sistema Estas constantes tienen un valor de
A12=1/b(2) A21=(b(1)+b(2))^(-1) % La literatura(Perry, 1998) reporta las constantes de A12=-0.8343 y A21=-0.5899 % para este mismo sistema
A12 = -0.813012799210975 A21 = -0.752118245513972